Facteurs de risque des cancers de la cavité
buccale, du pharynx (cavum exclu) et du larynx
Summary
Risk factors for cancers of the oral cavity, pharynx (cavity
excluded) and larynx
Objective > To review the risk factors for squamous cell carcinoma
of the oral cavity, pharynx, and larynx.
Methods > Review of the literature using the Medline digital
database (1980–2007). Previously published studies or studies not
found in the database were included if relevant. Four types of
studies were selected: (1) epidemiological, (2) toxicologic, (3)
clinical, and (4) fundamental research. Publications concerning
cancer of the nasopharynx were excluded. This work is based upon
the ANAES guide for analysis of the literature and rating of
guidelines, published in January 2000.
Results > The principal risk factors are tobacco and alcohol. Other
risk factors, particularly infectious (viral) or environmental (nutritional
and occupational), are also involved. From this analysis we
conclude that: (1) most clinical and fundamental publications
concern smoking and alcohol use; (2) studies of other risk factors are
relatively old, especially those concerning nutritional and occupational
factors; (3) most publications have a low level of scientific
Résumé
Objectif > Faire le point sur les facteurs de risque des carcinomes
épidermoïdes de la cavité buccale, du pharynx et du larynx.
Méthodes > Revue de la littérature à partir de la base de données
informatisée Medline (1980–2007). Des études antérieures citées
dans les articles retenus, ou ne faisant pas partie de la base de
données, ont été incluses en fonction de leur pertinence. Quatre type
d’études ont été sélectionnés : (1) études épidémiologiques ; (2)
études toxicologiques ; (3) études cliniques ; (4) recherche fondamentale.
Ont été exclues de ce travail toutes les publications relatives
au cancer du rhinopharynx. Notre travail s’est appuyé sur le guide
d’analyse de la littérature et gradation des recommandations, publiée
par l’Anaes en janvier 2000.
Résultats > Les facteurs de risques principaux sont le tabac et l’alcool.
D’autres facteurs en particulier infectieux (virus) ou environnementaux
(nutritionnels et professionnels) sont également impliqués. Il
ressort de notre analyse que : (1) l’essentiel des publications cliniques
et fondamentales portent sur le tabac et l’alcool ; (2) pour les autres
facteurs de risques identifiés, les publications sont relativement
anciennes en particulier en ce qui concerne les facteurs nutritionnels
et professionnels ; (3) la plupart des publications ont un faible niveau
proof (grade C, levels 3 and 4). These 3 points explain the delay in
the analysis of risk factors for upper aerodigestive tract (UADT)
cancers.
Conclusions > We must make up for this delay by prospective
studies that include very large samples and use thorough and
multivariate statistical analyses to estimate the impact of various
toxic substances on the incidence of UADT cancer. This demands: (1)
awareness on the part of all physicians who manage this type of
cancer of the need to ask questions about exposure to risk factors
besides than tobacco and alcohol; (2) collaboration between these
physicians as well as with general practitioners, epidemiologists,
nutritionists, and occupational physicians.
de preuve scientifique (grade C, niveaux 3 et 4). Ces 3 points
traduisent le retard qui a été pris en ce qui concerne l’analyse des
facteurs de risques des cancers des voies aérodigestives supérieures
(VADS).
Conclusions > Il y a nécessité de combler le retard pris par le biais
d’études incluant un grand nombre de patients, de façon prospective,
en ayant recours à des analyses statistiques approfondies multivariées
et ce, dans le but de faire ressortir l’impact de chacun des
toxiques sur l’incidence des cancers des VADS. Cela suppose : (1) une
prise de conscience de la part de l’ensemble des médecins qui
prennent en charge ce type de cancer, de la nécessité de rechercher
par l’interrogatoire d’autres facteurs de risque que le tabac et l’alcool ;
(2) une collaboration entre ces médecins mais également les médecins
généralistes, les épidémiologistes, les nutritionnistes et les
médecins du travail
Les cancers des voies aérodigestives supérieures (VADS)
comportent 3 sous groupes (figure 1) :
les cancers des glandes salivaires ;
les cancers rhinosinusiens ;
les cancers de la cavite´ buccale, du pharynx et du larynx.
Parmi les cancers du pharynx, on distingue les tumeurs du
cavum ou rhinopharynx qui sont pour la plupart des cancers de
type UCNT (Undifferential Cancer Nasopharyngeal Type). Pour
ces cancers, l’implication du virus Epstein-Barr dans le processus
de cancérogenèse a été identifiée au début des années
1990 [1]. Cette localisation anatomique n’a pas été prise en
compte dans notre travail.
La fréquence des cancers de la cavité buccale, du pharynx et du
larynx augmente dans le monde [2]. Il s’agit dans plus de 90 %
des cas de cancers malpighiens dont il existe différents sousgroupes
selon la classification de l’OMS (Organisation mondiale
de la santé) [3]. Ce ne sont plus uniquement les hommes d’âge
mûr (50–60 ans) alcoolotabagiques qui sont concernés, mais de
plus en plus de femmes et de sujets jeunes qui sont atteints par
ce type de tumeur [4]. Malgré les avancées thérapeutiques, le
1230
Ce qui e´ tait connu
Cancers des voies aérodigestives supérieures : 17 000 nouveaux
cas/an en France.
Les 2 toxiques principaux identifiés : le tabac et l’alcool.
Ce qu’apporte notre travail
D’autres facteurs de risque sont probablement incriminés : le
cannabis, les virus de la famille des Papilloma virus, l’hygiène
dentaire, les facteurs environnementaux (nutritionnels, professionnels),
l’immunodépression (VIH).
Nécessité d’une collaboration entre spécialistes d’organe (ORL,
chirurgiens maxillo-faciaux), mais aussi médecins généralistes,
nutritionnistes, épidémiologistes, médecins du travail pour mieux
identifier ces facteurs.
Proposition de centralisation de ces données au niveau des
registres du cancer regroupés dans le réseau Francim.
De la bonne connaissance de ces facteurs de risque, pourrons
déboucher des actions en termes de prévention primaire susceptibles
de diminuer l’incidence et la mortalité de ce type de cancer.
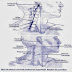
Figure 1
Représentation anatomique des voies aérodigestives
supérieures (VADS) sur une coupe sagittale médiane
(1) Rhinopharynx (cavum) ; (2) Oropharynx ; (3) Cavité buccale ; (4) Larynx ;
(5) Hypopharynx
pronostic de ces cancers reste médiocre, 35 à 40 % à 5 ans tous
stades et localisations confondues [5]. Un des moyens de faire
baisser la mortalité de ces cancers est la prévention primaire
mais cela nécessite, entre autres, d’individualiser parfaitement
les facteurs de risque susceptibles d’être impliqués dans la
survenue de ces tumeurs.
Même si l’alcool et le tabac demeurent les 2 toxiques majeurs
identifiés, il semble que d’autres facteurs, notamment environnementaux
et alimentaires, puissent être liés à la survenue des
cancers des VADS chez des patients non alcoolotabagiques. Le
but de notre travail était de faire le point sur les facteurs de
risque des cancers de la cavité buccale, du pharynx et du larynx
à partir des données de la littérature.
Méthodes
La recherche documentaire s’est faite à partir de la base de
données informatisée Medline (1980–2007) en utilisant
comme mots clés : « head and neck cancer », « squamous
cell carcinoma », « Tobacco », « Alcohol »,
« epidemiology », « carcinogen », « oncogenesis ». Ont été
exclues de ce travail toutes les publications relatives au cancer
du rhinopharynx compte tenu d’une épidémiologie très particulière
liée à ce type de cancer et de la nature histologique des
tumeurs rencontrées dans cette localisation anatomique.
Seules les publications traitant des cancers malpighiens de la
cavité buccale, de l’orohypopharynx et du larynx ont été
retenues.
Les auteurs de ce travail ont fait une première sélection
d’articles. Une seconde sélection a été faite par un médecin
ORL senior à partir des premiers articles sélectionnés. Des
études antérieures citées dans les articles retenus, ou ne faisant
pas partie de la base de donnée, ont été incluses en fonction de
leur pertinence. Quatre types d’études ont été sélectionnés :
e´ tudes e´ pide´ miologiques ;
e´ tudes toxicologiques ;
e´ tudes cliniques ;
recherche fondamentale.
Les facteurs de risque retenus l’ont été en fonction de leur
fréquence d’apparition dans les études.
Parmi les études cliniques, seules celles comportant un nombre
important de patients (>50) ont été retenues. Pour ces publications,
notre travail s’est appuyé sur le guide d’analyse de la
littérature et gradation des recommandations (A, B, C), publié
par l’Anaes en janvier 20006, afin d’évaluer le niveau de preuve
apporté en fonction de différents critères résumés dans le
tableau I.
Pour les études fondamentales, seules les publications
émanant d’équipes reconnues pour leurs travaux dans le
domaine de la cancérogenèse des cancers des VADS et décrivant
un mécanisme de cancérogenèse ont été retenues.
S’agissant d’une étude descriptive, il n’a pas été réalisé de
méta-analyse statistique.
Résultats
La recherche sur la base informatisée Medline a permis de
retrouver 258 articles. Après la première sélection opérée par le
groupe de lecture, 110 articles ont été retenus. Après relecture
par le médecin ORL senior, 77 ont été définitivement retenus. Si
l’on exclut les publications de l’OMS [3] et la classification de
l’Anaes [6], parmi les 75 publications restantes, 29 concernaient
des études épidémiologiques, 18 des études fondamentales,
17 des études toxicologiques et 11 des études cliniques.
Dans le chapitre qui suit, pour les études cliniques, le niveau de
preuve selon la classification de l’Anaes est indiqué entre
parenthèses.
Tabac
Le tabac peut être fumé, prisé ou chiqué. En France, le tabac
prisé et à chiquer est d’utilisation très marginale et représente
moins de 0,4 % du tabac consommé [7]. Le tabac à chiquer est
beaucoup moins toxique, mais il peut donner lieu à des cancers
des lèvres ou de la face interne des joues, car il peut être
mélangé à d’autres toxiques que sont la chaux, les feuilles de
bétel, et les noix d’Arèque ; ce type de consommation est très
répandu en Inde, à Taiwan et dans de nombreux pays d’Asie du
Sud-Est, mais également dans les populations migrantes issues
de ces régions géographiques [8]. L’utilisation du tabac sous
cette forme est tenue responsable d’une très forte augmentation
de l’incidence dans ces pays, de la fibrose sous-muqueuse
de la cavité buccale, en particulier chez les sujets jeunes et
indépendamment de la durée de consommation. Il s’agit d’une
lésion prénéoplasique qui est irréversible et sans traitement
connu. Le pourcentage de dégénérescence en carcinome malpighien
est particulièrement élevé.
Cependant, même utilisé seul, le tabac chiqué est toxique. C’est
ainsi que Schantz et Guo-Pei [9] ont attribué l’accroissement
des cancers de la langue chez les jeunes adultes aux États-Unis
à la forte augmentation de tabac à chiquer, confirmant le
rapport de l’International Agency for Research on Cancer (IARC)
de 1985 [10].
Aucune donnée épidémiologique concernant le tabac à priser
n’était disponible dans la littérature.
En France, c’est en 1954 qu’une première étude rétrospective
de 4000 malades atteints de cancers des VADS et un nombre
égal de sujets témoins non fumeurs a permis d’établir une
différence significative entre les 2 groupes, et donc d’imputer le
tabac comme facteur de risque [7]. Vingt ans plus tard en
Grande-Bretagne, Doll et Peto démontraient que le risque de
mortalité par cancer des VADS chez les fumeurs par rapport aux
non-fumeurs était augmenté de 2 à 12 en fonction de la
localisation, à l’exception des cancers des cavités rhinosinusiennes
et du cavum [11] (grade C). La corrélation entre le
risque accru de cancer chez les fumeurs et le siège du cancer est
probablement liée aux modalités du passage de la fumée de
tabac au contact des structures anatomiques, le contact se
faisant successivement avec les lèvres, la cavité buccale, l’oropharynx,
l’hypopharynx et le larynx. Szekely et al. [12] ont
montré que la sensibilité de la muqueuse au tabac et à l’alcool,
et donc le risque de développer un cancer, était décroissante de
la cavité buccale vers le larynx, avec un risque maximal au
niveau buccopharyngé, probablement par un contact plus étroit
et prolongé de la muqueuse avec les agents toxiques.
La consommation de cigarettes est la plus répandue, loin
devant celle du cigare et de la pipe. Une cigarette se compose
de 1 g de tabac, enrobé de papier qui est fait de chanvre, de lin
et autres ingrédients pour améliorer sa combustibilité. La
fumée de cigarette résulte de la combustion incomplète du
tabac. Elle contient 5 milliards de particules/mL ; ces particules
proviennent de la zone de combustion et sont générées par 3
réactions qui se produisent simultanément :
une pyrolyse qui de´ compose le tabac en petites mole´ cules ;
une pyrosynthe` se avec production de nouveaux composants ;
une distillation de certains composants du tabac. L’intensite´ de
ces re´ actions est directement lie´e a` la tempe´ rature de
combustion.
Physiopathologiquement, au sein de ces particules, 4 groupes
de substances sont distingués :
la nicotine ;
le monoxyde de carbone (CO) ;
les irritants (phe´ nols, alde´ hydes, acrole´ ı¨ne) ;
les substances cance´ rige` nes regroupe´ es en sous-classes dont
les 3 plus importantes sont les nitrosamines spe´ cifiques du
tabac, les arylamines et les hydrocarbures aromatiques
polycycliques dont le plus connu est le 3,4-benzo(a)pyre` ne
(3,4-BaP).
Les substances cancérigènes sont, pour une partie d’entre elles,
dissoutes dans la salive. Il s’agit en fait, pour la plupart, de
procarcinogènes inactifs rendus actifs grâce aux cytochromes
P450 1A1 [13]. C’est ainsi que le 3,4-BaP est transformé en un
carcinogène actif : le benzo (a) pyrène-diol-époxide. Des
travaux ont montré que le benzo (a) pyrène-diol-époxide
agissait directement sur l’ADN (acide désoxyribonucléique),
plus précisément au niveau des exons 4, 5, 6, 7 et 8 du
gène TP53 [14,15], gène clé dans la carcinogenèse des cancers
des VADS [16]. Il existe d’autres sous-classes de produit regroupant
plus de 50 substances cancérigènes [17].
Nous notons que le CO et la nicotine ne sont pas classés parmi
les substances cancérigènes. Toutefois, concernant la nicotine,
une étude faite in vitro sur des lignées cellulaires de cancers des
VADS a montré qu’elle pourrait être impliquée dans l’altération
du mécanisme d’apoptose [18]. Ce travail n’a jamais été
confirmé par d’autres études.
Le risque de cancer croît avec l’intensité et l’ancienneté du
tabagisme, avec une relation « dose-effet ». Le seuil critique se
situerait à 20 paquets-années, ce qui correspond à une
consommation d’un paquet de cigarettes par jour pendant
20 ans. Outre la consommation et l’ancienneté du tabagisme,
d’autres facteurs entrent en jeu :
l’inhalation de la fume´ e, qui augmente le risque [19] ;
la longueur du me´ got, car c’est dans le me´ got re´ duit que
s’accumule le plus de substances toxiques ;
le filtre dont le roˆ le reste controverse´ , diminuant le risque pour
certains auteurs, ne changeant rien pour d’autres [19] ;
le type de tabac, le tabac brun e´ tant plus toxique [20].
La cigarette est plus toxique que le cigare car celui-ci ne
comporte pas de papier, ce qui engendre une température
de combustion moins élevée et donc une production de particules
moins importante ; il en est de même pour la pipe [19]. Le
tabagisme passif a été mis en cause dès le début des années
1980, le risque cancérigène pour un conjoint non fumeur étant
de 3 par rapport à un sujet témoin non exposé [7].
La poursuite de l’intoxication tabagique après guérison d’un
premier cancer facilite l’apparition d’un second cancer des
VADS. Dès le début des années 1980, Silvermann et al. avaient
montré que la fréquence d’apparition d’un second cancer était
de 18 % chez le sujet ayant arrêté de fumer et de 30 % en cas
de poursuite de l’intoxication tabagique [21] (grade C).
On parle de facteurs de risque génétique lorsqu’un individu est
génétiquement prédisposé à la maladie cancéreuse ou plus
susceptible de développer un cancer après exposition à un
agent cancérigène. Pendant très longtemps, la notion de facteurs
de risque génétiques et cancers des VADS était un sujet
polémique. Plusieurs études ont suggéré l’existence d’une
« susceptibilité » individuelle aux carcinomes des VADS [22].
La notion de sujets « prédisposés » à développer un carcinome
des VADS repose, entre autres, sur le rapport des CDC (US
Centers for Disease Control) stipulant que sur les 46 millions de
fumeurs américains, seulement 40 000 à 50 000 développaient
chaque année un carcinome des VADS, soit moins d’un sujet
fumeur sur 1000 [23].
Le métabolisme des carcinogènes du tabac et les systèmes de
réparation des lésions de l’ADN sont 2 mécanismes dont on
connaît des différences d’activité d’origine héréditaire, pouvant,
au moins partiellement expliquer une variabilité de
sensibilité des individus aux méfaits du tabac.
Néanmoins la notion de cancers des VADS familiaux n’est
actuellement pas admise.
Génétique et métabolisation des carcinogènes du tabac
Au niveau de l’organisme, les carcinogènes du tabac sont
métabolisés par des enzymes dont le rôle majeur est leur
élimination. Certains des gènes codant pour ces enzymes ont
un polymorphisme. Pour un individu, hériter d’une enzyme à
activité réduite peut conduire à une accumulation excessive de
toxiques et à une diminution des capacités de détoxification.
Des études épidémiologiques ont été menées afin d’identifier,
parmi les polymorphismes des gènes impliqués dans le métabolisme
des carcinogènes du tabac, ceux pouvant constituer
des facteurs de risque pour les carcinomes des VADS [24]. Les
glutathions-S-transférases (GST) forment une famille d’isoenzymes
qui catalysent la conjugaison du gluthation sur des
substrats électrophiles. Ce sont des enzymes qui ont un rôle
majeur dans la détoxification de nombreux composés.
Dans la population caucasienne, 2 génotypes homozygotes nuls
de GSTM1 et GSTT1 sont détectés chez respectivement 40 et
15 % des sujets. Dans les 2 cas, il s’agit d’une double délétion
du gène avec comme conséquence une absence totale d’enzyme.
La double délétion de GSTM1 [25] et l’association des 2
génotypes homozygotes nuls de GSTM1 et GSTT1 augmentent
le risque de carcinome des VADS [26].
Les cytochromes P450 forment une famille d’enzymes qui
intervient également dans le métabolisme de nombreux toxiques.
Parmi eux, rappelons les cytochromes P450 1A1
(=CYP1A1 MspI) et 2E1 (=CYP2E1 PstI) qui métabolisent le
B(a)P en B(a)P-diol-époxide [25]. Il est décrit chez certains
sujets une hyperactivité du CYP1A1 associée à une augmentation
des adduits du B(a)P sur l’ADN et une augmentation
du risque de cancer du larynx et de la cavité buccale chez
les fumeurs [15]. Il a été montré que l’association d’une
hyperactivité du CYP1A1 et du génotype GSTM1 nul constituait
un risque multiplicatif pour les carcinomes des VADS [25].
Génétique et réparation de l’ADN
De nombreux systèmes de réparation permettent le maintien
de l’intégrité du génome et les altérations subies par la
molécule d’ADN peuvent être réparées. Les carcinogènes du
tabac étant à l’origine de dommages sur l’ADN, il est concevable
qu’une variabilité des systèmes de réparation entraîne
chez le fumeur une variabilité du risque de cancer.
Deux tests de sensibilité à des agents mutagènes ont été mis au
point à partir de cultures in vitro de lymphocytes circulants :
un test direct de re´ activation cellulaire en utilisant un « ge` ne
reporter » alte´ re´ par le benzo(a)pyre` ne-diol-e´ poxide (BPDE)
[27] ;
un test indirect qui e´ value la sensibilite´ de la cellule aux
mutage` nes [28], dans lequel sont comptabilise´ es les cassures au
niveau de la chromatine apre` s exposition a` un cytotoxique
(ble´ omycine) ou au BPDE.
Ces tests effectués sur des patients ayant un carcinome des
VADS et sur des patients témoins fumeurs (appariés sur la
consommation de tabac) mais indemnes de cancer, ont montré
qu’il existait un nombre de sujets ayant une sensibilité aux
carcinogènes et un défaut de réparation de l’ADN significativement
plus élevé dans le groupe des sujets porteurs d’un
carcinome des VADS. Les altérations des systèmes de réparation
de l’ADN peuvent être constitutionnelles ou acquises. Des
altérations constitutionnelles pour 2 gènes spécifiques de la
réparation de l’ADN ont été documentées pour les carcinomes
des VADS. Il s’agit des gènes XRCC1 et hMLH1. XRCC1 intervient
dans la réparation des cassures double brin de l’ADN. hMLH1
intervient dans la correction des discordances qu’il peut exister
dans la séquence des nucléotides entre les 2 brins d’ADN ; son
dysfonctionnement favorise l’apparition d’instabilités microsatellitaires,
elles-mêmes favorisant une instabilité génomique.
La présence de 2 polymorphismes de XRCC1 (XRCC1 26304 CC et
28152 AA) ou la baisse d’expression constitutionnelle de
hMLH1 sont associées à un risque accru de carcinomes des
VADS [29,30].
D’autres anomalies sont acquises lors de la cancérogenèse. Ces
anomalies peuvent favoriser, en retour, l’accumulation progressive
d’anomalies impliquées dans le développement du
cancer. L’interactivité qui existe entre les mécanismes de la
cancérogenèse et les mécanismes susceptibles de les contrer
crée les conditions propices au bouleversement complet de
l’homéostasie cellulaire.
Sous l’effet conjoint du tabac et de l’alcool vont s’accumuler, au
sein des cellules exposées, des radicaux libres, dont le benzo
(a) pyrène-diol-époxide à l’origine de l’altération, par oxydation,
des nucléotides constitutifs de l’ADN [31]. Une vingtaine
d’altérations de ce type ont été répertoriées dans les carcinomes
des VADS, dont la plus fréquente est la 8-oxo-guanine
[17]. En cas d’absence de réparation de la 8-oxo-guanine, celleci
peut être remplacée par une adénine favorisant la transversion
G :C ! T : A ; ce type de mutation est une des plus
fréquentes relevées au niveau de TP53 [32]. Le gène hOGG1
(human 8-oxo-Guanine DNA glycosylase 1) code pour une
protéine capable de transformer la 8-oxo-guanine en
guanine ; ce gène est localisé sur le bras court du chromosome
3 en 3p26.2, une région fréquemment délétée dans les carcinomes
des VADS et ce, à un stade très précoce de la carcinogenèse
[17]. Il n’y a aucune mutation identifiée pour le gène
hOGG1 [33,34] et donc, contrairement à ce qui est habituellement
le cas lors de perte d’hétérozygotie, l’inactivation de
l’allèle correspondant ne l’est pas par mutation. Des études
complémentaires concernant les mécanismes d’inactivation
d’hOGG1 dans les carcinomes des VADS sont donc nécessaires.
Une des axes de recherche est la mise en évidence d’anomalies
épigénétiques, en particulier la méthylation de la région promotrice
de ce gène [35].
En somme, le gène hOGG1 peut être considéré comme un gène
important dans les processus de réparation de l’ADN des
carcinomes des VADS, mais également comme un gène protecteur
de la muqueuse des VADS contre les effets des radicaux
libres accumulés sous l’effet, entre autres, de l’intoxication
alcoolotabagique.
Un autre gène important dans la réparation de l’ADN est le O6-
méthylguanine DNA méthyltransférase (MGMT). MGMT code
pour une protéine capable de transformer l’O6- méthyl (alkyl)
guanine, un des 13 nucléotides modifiés induits par les nitrosamines
contenues dans la fumée de tabac, en guanine. Si elle
est non réparée, l’O6-méthyl (alkyl) guanine peut être remplacée
par une thymine favorisant la transition G :C!T :A [17].
Ce type de mutation ponctuelle, similaire à la transversion G :C
en T :A, est fréquemment relevé au niveau de TP53 dans les
carcinomes des VADS. Un des mécanismes principaux d’inactivation
de MGMT est la méthylation de la région promotrice de
ce gène.
hMLH1 est un gène important dans le contrôle de la stabilité du
génome en empêchant l’apparition d’instabilités microsatellitaires.
Les mécanismes d’inactivation de ce gène dans les
carcinomes des VADS sont encore mal définis. Il est probable
que l’hyperméthylation de la région promotrice de ce gène soit
un mécanisme important.
Alcool
La consommation d’alcool est très élevée en France par rapport
aux autres pays de la Communauté Européenne. Elle a baissé
régulièrement depuis 40 ans, alors qu’elle a augmenté dans les
autres pays. L’enquête la plus récente sur la consommation
d’alcool en France est une enquête téléphonique, auprès de
30514 personnes âgées de 12 à 75 ans, analysant le nombre de
verres d’alcool bus par jour, quel que soit le type d’alcool [36].
Ce travail fait apparaître que seulement 17 % de la population
étudiée déclarait ne pas avoir consommé d’alcool au décours
des 12 derniers mois et que les hommes représentaient 70 %
de la population des buveurs. Parmi les buveurs, cette enquête
a mis en évidence 3 sous-groupes :
les petits buveurs (moins de 3 verres/24 h) ;
les moyens buveurs (3 a` 5 verres/24 h) ;
les gros et les tre` s gros buveurs (>5 verres/24 h).
Chacun des groupes représentant respectivement 60, 27 et
13 % de la population interrogée.
La plupart des études n’ont pas mis en évidence d’augmentation
du risque de morbidité pour une consommation d’alcool
<2 verres par jour. Le risque de survenue d’un cancer des VADS
augmente dès lors que la consommation d’alcool devient >2
verres par jour [37]. Enfin, à partir d’une consommation >5
verres, le risque de survenue d’un cancer des VADS est doublé
par rapport aux non-buveurs [37], le risque augmentant régulièrement
avec la dose d’alcool pur contenu dans les boissons
alcoolisées, sans effet de seuil [38,39]. Le risque de cancer des
VADS est indépendant du type de boisson consommé [40].
L’alcool seul, à la différence du tabac, ne provoque pas de
cancer chez l’animal, même si certains cancérigènes comme les
nitrosamines sont retrouvés dans des boissons alcoolisées,
notamment la bière. Le mécanisme exact par lequel l’alcool
provoque une transformation maligne des cellules épithéliales
des VADS n’est pas élucidé [41]. Néanmoins, on lui attribue
comme rôles :
celui de solvant des carcinoge` nes re´ sultants de la combustion
du tabac, favorisant leur passage transmuqueux ;
de diminuer la protection muqueuse par la salive par le biais
de l’irritation locale provoque´ e par l’e´ thanol ;
de favoriser une atrophie muqueuse [40] ;
d’activer les cytochromes P450 1A1 et donc de favoriser la
transformation de procarcinoge` nes contenus dans la fume´e de
tabac en carcinoge` nes actifs [42] ;
d’induire des de´ ficiences nutritionnelles avec hypovitaminoses,
vitamines A et C en particulier, qui facilitent l’e´ mergence
des cancers d’une fac ¸
on ge´ ne´ rale, par de´ ficit en antioxydants ;
d’induire au niveau de la muqueuse, par le biais de son
me´ tabolisme, la production d’ace´ talde´ hyde qui est un me´ tabolite
carcinoge` ne [40].
Concernant le dernier point il a été montré que le déficit de 2
enzymes impliquées dans le métabolisme de l’acétaldéhyde
(ADH alcool-déshydrogénase et alDH aldéhyde-déshydrogénase),
conséquence d’un polymorphisme génétique, augmentait
le risque de cancer des VADS [40].
L’intoxication tabagique et l’imprégnation éthylique sont souvent
associées, et leurs effets sur le risque de cancer des VADS
sont multiplicatifs [43]. Cet effet synergique entre les 2 toxiques
est connu depuis les travaux de Rothman et Keller [44]
dans les années 1970. Dans cette étude, si le risque relatif (RR)
était de 1 chez les « non-buveurs, non-fumeurs », il s’élevait à
2,33 chez les « grands-fumeurs, non-buveurs », à 2,43 chez les
« grands-buveurs, non-fumeurs », et à 15,5 chez les « grandsbuveurs,
grands-fumeurs ». Ces résultats ont été confirmés par
les travaux de Tuyns et al. [45] (grade C) à la fin des années
1980.
En termes de localisations, plusieurs études ont mis en évidence
que les 3 localisations les plus fréquentes parmi les
cancers des VADS en cas d’intoxication alcoolique étaient :
la cavite´ buccale ;
l’oropharynx ;
l’hypopharynx.
Dans une étude menée par l’Institut Curie à la fin des années
1980, si le RR était de 1 chez les buveurs de moins de 40 g
d’alcool/24 h, il s’élevait chez les buveurs de 160 g et plus à
67,8 pour le larynx, 88,7 pour l’oropharynx, 257.,5 pour l’hypopharynx
et 579 pour la cavité buccale [46]. Le risque particulièrement
élevé en ce qui concerne la cavité buccale a été
confirmé [47].
Autres facteurs de risque
Facteurs viraux
Le rôle des virus dans la genèse des cancers des VADS reste
incertain. Il n’y a pas de preuve de la relation causale entre ces
cancers et les adénovirus, les cytomégalovirus, le virus varicelle-
zona (VZV), le virus herpétique humain 6 (HHV-6). En
revanche, d’autre virus sont incriminés. Ce sont les virus de la
famille des Human Papilloma Virus (HPV) [48,49].
Une étude épidémiologique rétrospective portant sur 292
patients atteints d’un carcinome des VADS et 1568 sujets
témoins a montré, par détermination de la séropositivité
HPV-16, que le risque était significativement associé à l’infection
par l’HPV16 (RR = 2,2) ; dans cette étude, les auteurs ont
montré que le risque était dépendant du site anatomique, avec
un niveau particulièrement élevé dans les cas de tumeurs de
l’amygdale (RR = 10,2) et de la base de langue (RR = 20.7), par
rapport aux autres localisations [15]. D’autres études ont
montré la présence de particules virales en plus grande quantité,
50%en moyenne, dans les tumeurs de la cavité buccale et
de l’oropharynx, par rapport à la muqueuse normale et ce, qu’il
y ait ou non intoxication alcoolotabagique [48,50]. C’est ainsi
que Smith et al. ont montré l’intérêt de rechercher l’HPV dans
les cellules épithéliales de la cavité buccale collectées par
brossage, pour l’identification des patients à risque de développer
un carcinome épidermoïde, indépendamment du degré
d’intoxication alcoolotabagique [51].
En revanche pour les tumeurs du larynx, alors que la papillomatose
laryngée est liée à l’infection par HPV, le risque de
dégénérescence est faible et semble plus lié à une intoxication
tabagique concomitante [52].
Deux types d’HPV sont carcinogènes : les HPV 16 et 18. Pour
certains auteurs, ils agiraient en entraînant soit une mutation
de TP53, soit une inactivation des protéines p53 et Rb par
l’intermédiaire de 2 oncoprotéines virales E6 et E7 [53]. Pour
d’autres auteurs, ils n’interviendraient que comme cocarcinogènes
[54].
Même si les études ne sont pas unanimes quant à la participation
de l’HPV dans la cancérogenèse des carcinomes des VADS,
il est vraisemblable que cet agent infectieux rende compte
d’une partie des carcinomes des VADS diagnostiqués chez les
patients n’ayant pas d’intoxication alcoolotabagique (5 à 10 %
en fonction des études) [40].
Cannabis
Déjà signalée par Almadori [55] en 1990 en Italie, la consommation
de marijuana fait actuellement l’objet d’études aux
États-Unis pour expliquer l’augmentation des cas chez les
adultes de moins de 40 ans atteints de cancer des VADS, en
particulier de la langue mobile [7]. Ces études épidémiologiques
sont appuyées par des données expérimentales sur des
modèles animaux [56].
Le risque de développer un cancer des VADS avec la marijuana
est dose-dépendant (fréquence et durée de l’intoxication) [57].
Par ailleurs, il existe souvent une consommation de tabac et
d’alcool simultanée, ce qui rend difficile la détermination du
rôle respectif de chacun des toxiques. Des études épidémiologiques
avec des analyses statistiques multivariées sont donc
nécessaires.
État dentaire
Il est habituel de souligner le mauvais état dentaire des
patients pris en charge pour un cancer des VADS. Toutefois il
est difficile de faire la part entre ce qui pourrait être le reflet
d’un contexte socioculturel et ce qui serait un agent causal
incontestable. Nous pouvons malgré tout supposer que les
traumatismes dentaires répétés sur des chicots dentaires, les
modifications du pH salivaire engendrées par une infection
chronique peuvent avoir un rôle, au moins comme cofacteurs,
dans la genèse de ces cancers [58] (grade C).
Seule une étude chinoise a conclu qu’un mauvais état dentaire
pouvait être un facteur de risque indépendant pour les cancers
de la cavité buccale [59] (grade C). Toutefois, la plupart des
études tendent à montrer que l’impact de l’alcoolotabagisme
prévaut largement sur le contexte dentaire ou prothétique
dentaire.
Facteurs nutritionnels
Un cas particulier mérite d’être individualisé, celui du syndrome
de Plummer-Vinson ou Kelly Patterson, décrit simultanément
et respectivement aux États-Unis et en Grande-
Bretagne [7]. Il s’agit d’un syndrome associant une anémie
sidéropénique et une atrophie des muqueuses digestives,
retrouvé dans 50 à 90 % des cas de cancers de la région
du rétrocricoïde (sous-localisation hypopharyngée), notamment
chez la femme, et ce en dehors de toute exogénose.
L’amélioration de la diététique avec l’apport de fer dans
l’alimentation a fait chuter radicalement la fréquence de ce
syndrome et de ce type de cancer [60].
Les carences vitaminiques, notamment en vitamines A [61] et C
[62], liées à une alimentation mal équilibrée faciliteraient
l’éclosion des cancers d’une façon générale par l’intermédiaire
d’une accumulation de radicaux libres [63]. La moindre incidence
des cancers en cas d’alimentation riche en légumes et en
fruits est incontestable ; c’est ainsi que le risque de cancer de
l’oropharynx et de l’hypopharynx est 3 à 5 fois moindre selon
l’importance relative de ce type d’aliments [4]. L’alimentation
mal équilibrée avec un excès de consommation de graisses
d’origine animale, qui caractérise les patients ayant un cancer
des VADS, pourrait être l’expression d’un contexte socioéconomique,
ou la traduction des désordres générés par l’alcoolisme
autant que d’être de réels facteurs épidémiologiques ; la valeur
statistique de leur association au risque de cancer diminue
notablement lorsque les données sont ajustées sur le tabac et
l’alcool [64] (grade C).
En raison de l’implication probable de carences vitaminiques
dans la cancérogenèse des cancers des VADS, des essais
thérapeutiques basés sur l’administration de dérivés de la
vitamine A ont été réalisés. Mackerras et al. ont montré que
la prise de bêtacarotène pouvait diminuer le nombre de cancers
des VADS [65] (grade C). Dans une première étude, Hong et al.
avaient montré que l’administration d’un dérivé de la vitamine
A, l’isotrétinoïne, pouvait prévenir l’apparition d’un second
cancer, chez les patients ayant déjà eu un cancer des VADS
[66] (grade B) ; ces résultats ont été infirmés par la même
équipe [67] (grade A), dans une étude randomisée de phase III
ayant inclus plus de 1000 patients. Dans le groupe de patients
ayant reçu 30 mg/24 h d’isotrétinoïne, l’apparition de seconds
cancers n’était pas significativement diminuée par rapport au
groupe n’ayant pas reçu de traitement. Ces résultats sont en
accord avec une étude française du GETTEC (Groupe d’étude de
tumeurs de la tête et du cou) [68] (grade B), qui avait montré
l’absence de bénéfice de l’administration d’un rétinoïde pour
prévenir l’apparition d’un second cancer.
Immunodépression
Dans la population des patients infectés par le VIH (virus de
l’immunodéficience humaine), le taux de cancers, toutes localisations
confondues, a tendance à augmenter ; les cancers des
VADS n’échappent pas à cette évolution épidémiologique [69].
Plusieurs explications sont possibles :
l’augmentation de la longe´ vite´ lie´ e aux traitements
antiviraux ;
l’immunode´ pression qui favorise l’apparition de le´ sions
pre´ ne´ oplasiques susceptibles de de´ ge´ ne´ rer en cancer, comme
cela avait e´ te´ de´ montre´ de` s la fin des anne´ es 1980 [70] ;
la fre´ quence e´ leve´ e de l’intoxication alccolotabagique et
l’addiction pour les stupe´ fiants, dont le cannabis, pour une part
des patients infecte´ s.
Facteurs professionnels
Les facteurs professionnels sont difficiles à apprécier, car souvent
étudiés dans des populations de patients ayant un cancer
des VADS, rarement dans des études cas-témoins. Il est difficile
de faire la part des choses entre l’intoxication alcoolotabagique
et l’exposition à un éventuel toxique, ce d’autant que les
patients sont le plus souvent incapables de préciser à quelle
exposition ils sont soumis, du fait d’activités multiples avec des
postes de travail variables. Le facteur « temps » est également
à prendre en compte. Les études toxicologiques étant souvent
rétrospectives, le facteur temps est difficile à évaluer. C’est dire
qu’il faut prendre avec beaucoup de précautions les données
sur les expositions professionnelles dans ce type de cancers.
Quelques études ont observé un rôle pathogène à certaines
expositions comme les métaux, en particulier le nickel [71], les
polyvinyles [72], les vapeurs de diesel [73], les aérosols d’huile
[74] et enfin l’amiante [75]. Bien connue pour être la cause de
nombreux cancers du poumon et de la plèvre, l’amiante est
donné, dans les travaux de Muscat, comme facteur d’une
élévation modérée mais non significative de la fréquence
des cancers des VADS ; en revanche, il est prouvé que l’exposition
augmente le risque chez le sujet tabagique [76] (grade
C).
Il ressort de notre analyse de la littérature que :
l’essentiel des publications cliniques et fondamentales portait
sur le tabac et l’alcool ;
pour les autres facteurs de risques identifie´ s, les publications
e´ taient anciennes, en particulier en ce qui concerne les facteurs
nutritionnels et professionnels ;
la plupart des publications cliniques avaient un faible niveau
de preuve scientifique (grade C, niveaux 3 et 4).
Discussion
L’analyse des résultats traduit le retard qui a été pris en ce qui
concerne l’analyse des facteurs de risque des cancers des
VADS ; ils soulignent la nécessité de combler ce retard par le
biais d’études incluant un grand nombre de patients, de façon
prospective, en ayant recours à des analyses statistiques approfondies
multivariées et ce, dans le but de faire ressortir
l’impact de chacun des toxiques sur l’incidence des cancers des
VADS. Cela suppose une prise de conscience de la part de
l’ensemble des médecins qui prennent en charge ce type de
cancer, en particulier les spécialistes d’organes que sont les
otorhinolaryngologistes et les chirurgiens maxillofaciaux, de la
nécessité de rechercher par l’interrogatoire d’autres facteurs de
risque que le tabac et l’alcool.
Ceci suppose également une collaboration entre ces spécialistes
d’organes mais également les médecins généralistes, les
épidémiologistes, les nutritionnistes et les médecins du travail.
À l’heure actuelle, ce type de collaboration n’est pas optimal, du
moins en France. Or il est impératif de colliger un maximum de
données sur les facteurs de risques potentiels, tout particulièrement
chez les patients non alcoolotabagiques qui semblent
représenter une part de plus en plus importante des patients
traités, au delà des 5 % rapportés habituellement dans la
littérature [24,38]. Malheureusement nous ne disposons pas
de chiffres précis et récents concernant le pourcentage exact
que représente ce groupe de patients, que ce soit en France ou
dans les autres pays. Il est d’ailleurs fort probable que les
facteurs environnementaux (nutrition, expositions professionnelles)
et les facteurs viraux ont été largement sous-estimés
jusqu’à présent, pouvant expliquer en partie l’augmentation
des cancers des VADS chez cette catégorie d’individus. En
France, les registres du cancer regroupés dans le réseau Francim
ont sans nul doute un rôle essentiel à jouer dans la
coordination des différents intervenants que nous venons de
citer et dans la centralisation des données épidémiologiques.
En identifiant de nouveaux facteurs de risques potentiels, il sera
alors possible d’agir en prévention primaire et de contribuer à
faire diminuer la fréquence et la mortalité par cancer des VADS.
Les campagnes d’information et de lutte contre l’alcoolisme et
le tabagisme en France illustrent parfaitement l’impact possible
sur la prévention primaire de ce type de cancer.
La consommation d’alcool diminue régulièrement en France
depuis les années 1950. Cette consommation continue de
diminuer ; ainsi, avec 3,4 L d’alcool pur par habitant consommés
en 2005, elle ne représente qu’1/3 de la consommation de
2003 estimée à 9,3 L d’alcool pur [36]. Une telle réduction de la
consommation en un espace de temps aussi court demande à
être vérifiée. En effet, plusieurs points doivent rendre prudente
l’analyse des données recueillies lors de l’enquête téléphonique
menée en 2005 :
les personnes interroge´ es ont tendance a` sous-estimer leur
consommation re´ elle ;
les chiffres obtenus en 2003 l’ont e´ te´ a` partir des quantite´ s
de´ clare´ es d’alcool vendu en France et non a` partir d’une enqueˆ te
te´ le´ phonique.
Toutefois on peut y voir le résultat des campagnes de prévention
que ce soit à la télévision, dans la presse écrite (médicale
ou non), dans les campagnes d’affichages depuis le milieu des
années 1990. Cette diminution de la consommation a eu un
effet bénéfique sur la mortalité masculine par cancer de la
cavité buccale, du pharynx et du larynx (figure 2). Les comportements
se sont également modifiés avec un renforcement
de la notion de plaisir associé à la consommation d’alcool. Ainsi,
la consommation moyenne annuelle double entre les tranches
d’âge 20–25 ans et 65–75 ans ; s’ils sont relativement peu
nombreux à consommer de l’alcool quotidiennement, les
jeunes ont plus fréquemment des comportements d’ivresse
que leurs aînés avec au moins 48,3 % des hommes et 20 % des
femmes de 20 à 25 ans buveurs avouant avoir eu au moins une
ivresse au cours des 12 derniers mois [36]. L’impact de cette
alcoolisation massive et sévère, rencontrée principalement le
Figure 2
Évolution de la mortalité par cancer des VADS en France depuis
1950 (d’après Hill [39])
week-end, est encore mal défini d’une façon générale et
encore moins pour les cancers des VADS.
La mortalité observée en 1995 (figure 2) est la conséquence
d’habitudes prises 20 à 50 ans auparavant. Nous sommes donc
en train d’observer la fin des conséquences des comportements
des années 1940 et le début de celles des comportements des
années 1970. Ainsi pour le tabac, la consommation ayant
augmenté jusqu’en 1975 (figure 3), le nombre de cancers
de la cavité buccale du pharynx et du larynx va continuer à475
Figure 3
Évolution des ventes et du prix de tabac en France (d’après Hill
[39]). Sources : Dominique Dubeaux, Insee, pour le prix et
Monique Padioleau, Seita, pour les ventes. Les prix sont relatifs,
base 100 en 1970, le tabac est exprimé en grammes par adulte et
par jour
augmenter au moins jusqu’en 2020. L’augmentation sera particulièrement
importante chez les femmes qui fumaient encore
très peu à la fin des années 1980, à l’exception des femmes
jeunes [38]. Ceci explique que l’augmentation des cancers liés
au tabac, qu’ils soient pulmonaires ou des VADS, a à peine
débuté en France dans la population féminine. Comme le
démontre très bien la figure 3, la consommation de tabac,
en particulier des cigarettes, est inversement proportionnelle
au prix. Il est probable que les très fortes hausses de prix
constatées depuis le début les années 2000 ont et auront des
conséquences en termes de consommation, même si nous ne
disposons pas encore de chiffres précis à ce sujet. Si cette
tendance se poursuit, l’impact sur la mortalité par cancer des
VADS sera différé dans le temps.
Conclusion
Comme nous venons de le voir, les facteurs de risque des
cancers des VADS sont très nombreux. Ceci implique que
l’interrogatoire des patients atteints par ce type de cancer soit
très approfondi en particulier chez les patients ne présentant
pas d’intoxication alcoolotabagique, mais également chez les
autres patients car les effets connus du tabac et de l’alcool
peuvent être amplifiés et aggravés par d’autres facteurs qu’ils
soient infectieux (virus) ou environnementaux (nutrition, facteurs
professionnels). En ce qui concerne le tabac et l’alcool, le
bilan qui vient d’être présenté souligne l’importance de la
prévention en convaincant l’ensemble de la population française
d’arrêter de fumer et de réduire sa consommation
d’alcool à 1 à 2 verres par jour, sans dépasser 3 verres. Si
les consommations de tabac et d’alcool continuent à diminuer,
la réduction de mortalité par cancers de la cavité buccale, du
pharynx et du larynx, commencée au milieu des années 1970,
se poursuivra. Enfin, la collaboration entre les médecins prenant
en charge ce type de cancer, les épidémiologistes, les
nutritionnistes et les médecins du travail est absolument
nécessaire pour avancer dans l’identification de nouveaux
toxiques autres que le tabac et l’alcool.

















0 commentaires:
Enregistrer un commentaire